Báo cáo đề xuất cấp giấy phép môi trường nhà máy sản xuất Dược Phẩm
Báo cáo đề xuất cấp giấy phép môi trường (GPMT) nhà máy sản xuất Dược Phẩm. Sản phẩm của Cơ sở là dược phẩm các loại với hơn 300 đầu thuốc phân phối toàn quốc phục vụ cho các bệnh nhân tại Việt Nam.
Ngày đăng: 25-04-2025
243 lượt xem
DANH MỤC CÁC TỪ VÀ KÝ HIỆU VIẾT TẮT...................................................... vii
DANH MỤC CÁC BẢNG.............................................................................. viii
CHƯƠNG I. THÔNG TIN CHUNG VỀ CƠ SỞ................................................... 1
1.2.3. Văn bản thẩm định thiết kế xây dựng, các loại giấy phép có liên quan đến môi trường, phê duyệt dự án (nếu có)......... 2
1.2.4. Quyết định phê duyệt kết quả thẩm định báo cáo đánh giá tác động môi trường; các giấy phép môi trường thành phần (nếu có)......... 3
1.2.5. Quy mô của dự án đầu tư (phân loại theo tiêu chí quy định của pháp luật về đầu tư công): 4
1.3. CÔNG SUẤT, CÔNG NGHỆ, SẢN PHẨM SẢN XUẤT CỦA CƠ SỞ.................. 4
1.3.2.1. Sản xuất thuốc dạng gel và hỗn hợp dịch-kem................................................ 5
1.3.2.3. Sản xuất thuốc viên nén – viên nén bao phim................................................ 8
1.4. NGUYÊN LIỆU, NHIÊN LIỆU, VẬT LIỆU, ĐIỆN NĂNG, HÓA CHẤT SỬ DỤNG, NGUỒN CUNG CẤP ĐIỆN, NƯỚC CỦA CƠ SỞ........ 12
1.4.1. Nguyên, nhiên, vật liệu và hóa chất sử dụng tại cơ sở..................................... 12
1.5. CÁC THÔNG TIN KHÁC LIÊN QUAN ĐẾN CƠ SỞ............................................ 44
1.5.3. Các hạng mục công trình bảo vệ môi trường của Cơ sở......................................... 46
1.5.3.4. Khu vực tập trung và lưu trữ chất thải rắn sinh hoạt, chất thải rắn sản xuất không nguy hại và chất thải nguy hại..... 48
CHƯƠNG II. SỰ PHÙ HỢP CỦA DỰ ÁN ĐẦU TƯ VỚI QUY HOẠCH, KHẢ NĂNG CHỊU TẢI CỦA MÔI TRƯỜNG....... 50
2.1. SỰ PHÙ HỢP CỦA CƠ SỞ VỚI QUY HOẠCH BẢO VỆ MÔI TRƯỜNG QUỐC GIA, QUY HOẠCH TỈNH, PHÂN VÙNG MÔI TRƯỜNG......... 50
2.2. SỰ PHÙ HỢP CỦA DỰ ÁN CƠ SỞ ĐỐI VỚI KHẢ NĂNG CHỊU TẢI CỦA MÔI TRƯỜNG........................... 51
CHƯƠNG III. KẾT QUẢ HOÀN THÀNH CÁC CÔNG TRÌNH, BIỆN PHÁP BẢO VỆ MÔI TRƯỜNG CỦA CƠ SỞ............. 53
3.1. CÔNG TRÌNH, BIỆN PHÁP THOÁT NƯỚC MƯA, THU GOM VÀ XỬ LÝ NƯỚC THẢI............ 53
3.1.1.3. Thu gom nước mưa về hệ thống thoát nước chung của Thành phố................... 54
3.1.3.1. Xử lý sơ bộ nước thải sinh hoạt trước khi đấu nối về HTXL nước thải............ 61
3.1.3.2. Xử lý sơ bộ nước thải từ nhà ăn trước khi đấu nối về HTXL nước thải............ 62
3.2. CÔNG TRÌNH, BIỆN PHÁP XỬ LÝ BỤI, KHÍ THẢI............................................ 80
3.2.1.1. Bụi, khí thải phát sinh từ các phương tiện giao thông......................................... 80
3.2.1.4. Khí ô nhiễm từ hệ thống thoát nước và xử lý nước thải tập trung..................... 82
3.2.2.2. Biện pháp giảm thiểu bụi từ hoạt động sản xuất.................................................. 84
3.2.2.2. Biện pháp giảm thiểu mùi từ hoạt động kiểm nghiệm......................................... 87
3.2.2.3. Biện pháp giảm thiểu bụi, khí thải từ máy phát điện dự phòng.......................... 90
3.2.2.5. Biện pháp giảm thiểu khí ô nhiễm từ hệ thống thoát nước và xử lý nước thải tập trung 90
3.2.2.7. Biện pháp giảm thiểu khí ô nhiễm từ khu vực lưu trữ chất thải rắn................... 91
3.2.2.9. Ảnh hưởng của khí thải tại cơ sở tới các đối tượng nhạy cảm xung quanh...... 91
3.3. CÔNG TRÌNH, BIỆN PHÁP LƯU GIỮ, XỨ LÝ CHẤT THẢI.............................. 92
3.3.1. Công trình, biện pháp lưu giữ, xử lý chất thải rắn sinh hoạt.................................. 92
3.3.1.1. Khối lượng CTR sinh hoạt phát sinh tại Cơ sở..................................................... 92
3.3.1.2. Phân loại CTR sinh hoạt của Cơ sở thành 02 nhóm như sau:........................... 92
3.3.1.4. Đánh giá khả năng đáp ứng của kho lưu chứa chất thải sinh hoạt:.................... 94
3.3.2. Công trình, biện pháp lưu giữ, xử lý chất thải rắn công nghiệp thông thường.... 94
3.3.2.1. Chủng loại, khối lượng CTR công nghiệp thông thường phát sinh tại Cơ sở 94
3.3.2.3. Đánh giá khả năng đáp ứng của khu vực lưu chứa chất thải rắn công nghiệp thông thường 95
3.4. CÔNG TRÌNH, BIỆN PHÁP LƯU GIỮ, XỬ LÝ CHẤT THẢI NGUY HẠI....... 96
3.4.1. Chủng loại, khối lượng CTNH phát sinh tại Cơ sở................................................. 96
3.4.4. Đánh giá khả năng đáp ứng của kho lưu chứa chất thải nguy hại khi Cơ sở hoạt động công suất tối đa:... 100
3.5. CÔNG TRÌNH, BIỆN PHÁP GIẢM THIỂU TIẾNG ỒN, ĐỘ RUNG................ 100
3.6. PHƯƠNG ÁN PHÒNG NGỪA, ỨNG PHÓ SỰ CỐ MÔI TRƯỜNG.................. 101
3.6.1. Phương án phòng ngừa, ứng phó sự cố liên quan đến hệ thống xử lý nước thải101
3.6.2. Phương án phòng ngừa, ứng phó sự cố cháy nổ.................................................... 103
3.6.3. Phương án phòng ngừa, ứng phó với sự cố tai nạn lao động............................... 104
3.6.4. Phương án phòng ngừa và ứng phó với sự cố giữa Cơ sở với các công trình lân cận 105
3.7. CÁC NỘI DUNG THAY ĐỔI SO VỚI QUYẾT ĐỊNH PHÊ DUYỆT KẾT QUẢ THẨM ĐỊNH BÁO CÁO ĐÁNH GIÁ TÁC ĐỘNG MÔI TRƯỜNG... 105
CHƯƠNG IV. NỘI DUNG ĐỀ NGHỊ CẤP PHÉP MÔI TRƯỜNG............................. 109
4.1. NỘI DUNG ĐỀ NGHỊ CẤP PHÉP ĐỐI VỚI NƯỚC THẢI.................................. 109
4.1.1.2. Dòng nước thải xả vào nguồn nước tiếp nhận, nguồn nước tiếp nhận nước thải, vị trí xả nước thải..... 109
4.1.2. Yêu cần bảo vệ môi trường đối với thu gom, xử lý nước thải............................. 110
4.1.2.1. Công trình, biện pháp thu gom, xử lý nước thải và hệ thống............................ 110
4.2. NỘI DUNG ĐỀ NGHỊ CẤP PHÉP ĐỐI VỚI KHÍ THẢI...................................... 115
4.2.3. Yêu cầu bảo vệ môi trường đối với thu gom, xử lý nước thải............................. 117
4.2.3.1. Công trình, biện pháp thu gom, xử lý bụi, khí thải và hệ thống....................... 117
4.3. NỘI DUNG ĐỀ NGHỊ CẤP PHÉP ĐỐI VỚI TIẾNG ỒN, ĐỘ RUNG............... 122
4.3.2. Yêu cầu bảo vệ môi trường đối với tiếng ồn, độ rung.......................................... 123
4.3.2.1. Công trình, biện pháp giảm thiểu tiếng ồn, độ rung.......................................... 123
4 4. NỘI DUNG ĐỀ NGHỊ CẤP PHÉP CỦA CƠ SỞ VỀ QUẢN LÝ CHẤT THẢI124
4.4.1.1. Chủng loại, khối lượng chất thải nguy hại phát sinh thường xuyên................ 124
4.4.1.2. Chủng loại, khối lượng chất thải rắn công nghiệp thông thường phát sinh thường xuyên 125
4.4.1.3. Chủng loại, khối lượng chất thải nguy hại phát sinh thường xuyên................ 125
4.4.2. Yêu cầu bảo vệ môi trường đối với việc lưu giữ chất thải rắn sinh hoạt, chất thải rắn công nghiệp thông thường, chất thải nguy hại........ 125
4.4.2.1. Thiết bị, hệ thống, công trình lưu giữ chất thải nguy hại.................................. 125
4.4.2.2. Thiết bị, hệ thống, công trình lưu giữ chất thải rắn công nghiệp thông thường126
4.4.2.3. Thiết bị, hệ thống, công trình lưu giữ chất thải rắn sinh hoạt........................... 126
4.4.3. Yêu cầu về phòng ngừa và ứng phó sự cố môi trường......................................... 126
CHƯƠNG V. KẾT QUẢ QUAN TRẮC MÔI TRƯỜNG CỦA CƠ SỞ...................... 127
5 1. KẾT QUẢ QUAN TRẮC MÔI TRƯỜNG ĐỊNH KỲ ĐỐI VỚI NƯỚC THẢI 127
5 2. KẾT QUẢ QUAN TRẮC MÔI TRƯỜNG ĐỊNH KỲ ĐỐI VỚI BỤI, KHÍ THẢI128
KẾ HOẠCH VẬN HÀNH THỬ NGHIỆM CÔNG TRÌNH XỬ LÝ CHẤT THẢI VÀ CHƯƠNG TRÌNH QUAN TRẮC MÔI TRƯỜNG CỦA CƠ SỞ.... 130
6.1. KẾ HOẠCH VẬN HÀNH THỬ NGHIỆM CÁC CÔNG TRÌNH XỬ LÝ CHẤT THẢI 130
6.1.2. Kế hoạch quan trắc chất thải, đánh giá hiệu quả xử lý các công trình, thiết bị xử lý chất thải 131
6.1.3. Tổ chức có đủ điều kiện hoạt động dịch vụ quan trắc môi trường...................... 132
6.2. CHƯƠNG TRÌNH QUAN TRẮC CHẤT THẢI THEO QUY ĐỊNH CỦA PHÁP LUẬT 133
6.3. TỔ CHỨC THỰC HIỆN CHƯƠNG TRÌNH GIÁM SÁT MÔI TRƯỜNG......... 135
CHƯƠNG VII. KẾT QUẢ KIỂM TRA, THANH TRA VỀ BẢO VỆ MÔI TRƯỜNG ĐỐI VỚI CƠ SỞ........ 136
CHƯƠNG VIII. CAM KẾT CỦA CHỦ CƠ SỞ............................................ 137
PHỤ LỤC........................................................ 138
CHƯƠNG I
THÔNG TIN CHUNG VỀ CƠ SỞ
1.1.TÊN CHỦ CƠ SỞ
Tên chủ cơ sở: CÔNG TY CỔ PHẦN DƯỢC PHẨM .....
Địa chỉ văn phòng:Khu công nghiệp Mỹ Phước 1, Phường Thới Hòa, Thị xã Bến Cát, Tỉnh Bình Dương
Người đại diện theo pháp luật của cơ sở: Ông .......
Chức vụ: Tổng Giám đốc
Chỗ ở hiện tại: .........Riverpark Residence, P. Tân Phong, Q. 7, TP. Hồ Chí Minh.
Điện thoại: ..... Fax: .....
Công ty Cổ phần Dược phẩm... có Giấy chứng nhận đăng ký doanh nghiệp mã số ..., đăng ký lần đầu ngày 07/06/2004, đăng ký thay đổi lần thứ 11 ngày 21/05/2024 do Phòng Đăng ký kinh doanh - Sở Kế hoạch Đầu tư tỉnh Bình Dương cấp (chuyển đổi tên do chuyển đổi doanh nghiệp từ Công ty TNHH Dược phẩm... theo đăng ký thay đổi giấy chứng nhận đăng ký doanh nghiệp lần thứ 8 ngày 16/08/2017).
Giấy chứng nhận đầu tư số ...., chứng nhận lần đầu ngày 06/11/2019, chứng nhận thay đổi lần thứ 02 ngày 09/06/2023.
1.2.TÊN CƠ SỞ
1.2.1.Tên cơ sở:
“NHÀ MÁY SẢN XUẤT DƯỢC PHẨM”
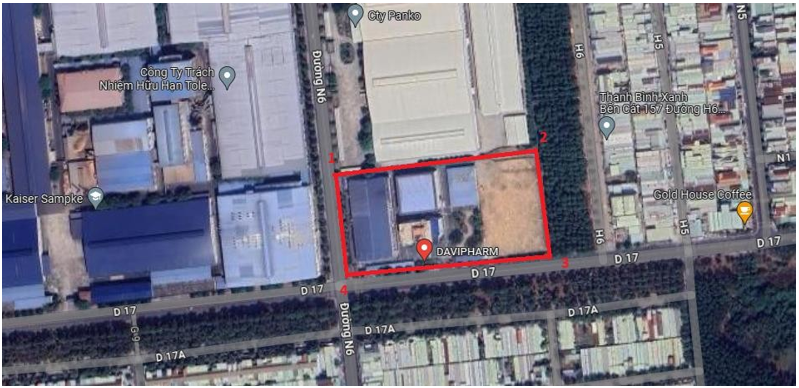
1.2.2.Địa điểm thực hiện cơ sở:
Địa điểm thực hiện: Khu công nghiệp Mỹ Phước 1, Phường Thới Hòa, Thị xã Bến Cát, Tỉnh Bình Dương.
Vị trí tiếp giáp của nhà máy được xác định như sau:
- Phía Bắc: giáp Công ty TNHH Panko Vina;
- Phía Nam: giáp đường D17 của KCN Mỹ Phước 1;
- Phía Đông: giáp đất cây xanh của KCN Mỹ Phước 1;
- Phía Tây: giáp đường N6 của KCN Mỹ Phước 1;
Hình 1. 1. Vị trí địa lý của cơ sở
Bảng 1. 1. Tọa độ vị trí khu đất
|
Vị trí khu đất |
Tọa độ VN-2000 (kinh tuyến 105o45’, múi chiếu 3o) |
|
|
X (m) |
Y (m) |
|
|
1 |
1229798 |
592716 |
|
2 |
1229823 |
592914 |
|
3 |
1229721 |
592927 |
|
4 |
1229697 |
592726 |
1.2.3.Văn bản thẩm định thiết kế xây dựng, các loại giấy phép có liên quan đến môi trường, phê duyệt dự án (nếu có)
Hợp đồng thuê lại đất không số giữa Công ty Thương mại Đầu tư và Phát triển (Becamex Corp) và Công ty TNHH Thương mại và Sản xuất ... (tiền thân của Công ty Cổ phần Dược phẩm) ngày 09/08/2004 với nội dung cho Công ty TNHH Thương mại và Sản xuất thuê 02 lô đất số M-7A1-CN và M- 7A3-CN với tổng diện tích đất là 15.500 m2.
Phụ lục hợp đồng thuê lại đất số 01 ký kết ngày 24/12/2004 với nội dung cho Công ty TNHH Thương mại và Sản xuất ... thuê lô đất số M-7A2-CN liền kề với 02 lô đất số M-7A1-CN và M-7A3-CN với diện tích 4.500 m2.
Phụ lục hợp đồng thuê lại đất số 02 ký kết ngày 20/11/2017 với nội dung gộp 3 lô đất M-7A1-CN, M-7A2-CN và M-7A3-CN thành 1 lô đất có thông tin Lô đất M-7A- CN có tổng diện tích là 20.000m2.
Giấy chứng nhận quyền sử dụng đất số BA-133701 cấp ngày 06/04/2010 cho công ty TNHH Dược phẩm ... tại thửa đất số Lô M-7A1-CN, Lô M-7A2-CN, Lô M-7A3-CN với mục đích sử dụng là đất khu công nghiệp, diện tích 20.000 m2, những thay đổi sau khi cấp giấy chứng nhận:
Chứng nhận bổ sung quyền sở hữu công trình của Công ty TNHH Dược phẩm ...(Tên công trình: Nhà văn phòng); Thửa đất có số thửa mới 982, tờ bản đồ số 6 và đổi tên huyện Bến Cát thành thị xã Bến Cát theo hồ sơ số 1620 ký duyệt ngày 17/11/2016;
Công ty TNHH Dược phẩm ... đổi tên thành Công ty Cổ phần Dược phẩm ... do chuyển đổi doanh nghiệp theo giấy chứng nhận đăng ký doanh nghiệp Công ty Cổ phần, mã số doanh nghiệp: 3700575898, đăng ký lần đầu ngày 07/6/2004, đăng ký thay đổi lần thứ 8 này 16/8/2017 do Phòng Đăng ký kinh doanh – Sở Kế hoạch và Đầu tư tỉnh Bình Dương, địa chỉ trụ sở chính: Lô M7A, đường D17, KCN Mỹ Phước 1, phường Thới Hòa, thị xã Bến Cát, tỉnh Bình Dương – theo hồ sơ số 0805 và ký duyệt ngày 28/6/2018;
Quyết định số 5929/QĐ-UBND ngày 24/11/2005 của UBND tỉnh Bình Dương về việc chấp thuận thiết kế kỹ thuật và xây dựng Công trình xưởng sản xuất và kinh doanh thuốc, mỹ phẩm (Nhà xưởng và nhà văn phòng, nhà bảo vệ và nhà khách, nhà xe, hồ nước ngầm, cổng và hàng rào, hạ tầng) của Công ty TNHH Dược phẩm ....;
Giấy phép xây dựng số 32/GPXD do Ban Quản lý các KCN Bình Dương – Uỷ ban Nhân dân Tỉnh Bình Dương cấp ngày 26/03/2014 cho Nhà văn phòng của Công ty TNHH Dược phẩm ...
Giấy phép xây dựng số 24/GPXD-BQL do Ban Quản lý các KCN Bình Dương – Uỷ ban Nhân dân Tỉnh Bình Dương cấp ngày 08/02/2018 cho Nhà kho của Công ty Cổ phần Dược phẩm ..
Giấy chứng nhận thẩm duyệt về PCCC số 505/TD-PCCC do Công an tỉnh Bình Dương cấp ngày 13/11/2008 cho Nhà máy sản xuất.
Giấy chứng nhận thẩm duyệt về PCCC số 96/TD-PCCC(P2) do Sở Cảnh sát PCCC tỉnh Bình Dương cấp ngày 14/03/2014 cho Nhà văn phòng.
Giấy chứng nhận thẩm duyệt về PCCC số 814/TD-PCCC(P2) do Sở Cảnh sát PCCC tỉnh Bình Dương cấp ngày 20/12/2017 cho Nhà kho.
Giấy phép xác nhận đấu nối không số ngày 11/11/2017 của Tổng Công ty Đầu tư & Phát triển Công nghiệp – TNHH Một Thành Viên (Becamex IDC) cấp cho Công ty Cổ phần Dược phẩm .. về việc đấu nối lâu dài đối với nước mưa và nước thải.
1.2.4.Quyết định phê duyệt kết quả thẩm định báo cáo đánh giá tác động môi trường; các giấy phép môi trường thành phần (nếu có)
Quyết định phê duyệt Đề án bảo vệ môi trường chi tiết số 109/QĐ-BQL ngày 25/04/2016 của Ban quản lý các Khu công nghiệp tỉnh Bình Dương cấp cho Công ty TNHH Dược phẩm ....
Số đăng ký chủ nguồn thải chất thải nguy hại mã số QLCTNH 74.000032.T do Chi cục Bảo vệ Môi trường – Sở Tài nguyên và Môi trường tỉnh Bình Dương cấp lần 4 ngày 15/11/2017.
1.2.5.Quy mô của dự án đầu tư (phân loại theo tiêu chí quy định của pháp luật về đầu tư công):
Cở sở hoạt động với ngành nghề: sản xuất thuốc, hóa dược và dược liệu thuộc lĩnh vực hóa dược, tổng mức đầu tư của dự án là 738.000.000.000 đồng (bằng chữ: Bảy trăm ba mươi tám tỉ đồng) thuộc dự án có tổng mức đầu tư từ 80.000.000.000 đồng đến dưới dưới 1.500.000.000.000 đồng, cơ sở thuộc Dự án nhóm B (Quy định tại Điểm e Khoản 03 Điều 8 và Khoản 2 Điều 9 Luật Đầu tư công số 39/2019/QH14 do Quốc hội nước Cộng hòa xã hội chủ nghĩa Việt Nam khóa XI thông qua ngày 13/06/2019, có hiệu lực thi hành ngày 01/01/2020).
Cơ sở không thuộc danh mục ngành nghề gây ô nhiễm môi trường theo Phụ lục II Nghị định 08/2022/NĐ-CP. Do đó, cơ sở thuộc phân loại nhóm II tại mục số 2 Phụ lục IV ban hành kèm theo Nghị định 08/2022/NĐ-CP.
Báo cáo đề xuất cấp giấy phép môi trường của cơ sở “Nhà máy sản xuất dược phẩm Davipharm” do Công ty Cổ phần Dược phẩm .. làm Chủ cơ sở được thực hiện theo Phụ lục X ban hành kèm theo Nghị định 08/2022/NĐ-CP ngày 10/01/2022.
1.3.CÔNG SUẤT, CÔNG NGHỆ, SẢN PHẨM SẢN XUẤT CỦA CƠ SỞ
1.3.1.Công suất hoạt động của Cơ sở
– Công ty Cổ phần Dược phẩm hoạt động với lĩnh vực chính là sản xuất thuốc, hóa dược và dược liệu (mã ngành 2100) theo giấy chứng nhận đầu tư số ..
Hiện tại, cơ sở đã sản xuất đạt công suất tối đa theo Quyết định số 109/QĐ-BQL ngày 25/04/2016 của Ban quản lý các Khu công nghiệp tỉnh Bình Dương về việc phê duyệt đề án bảo vệ môi trường chi tiết cho Công ty TNHH Dược phẩm...
Bảng 1. 2. Sản phẩm của cơ sở
|
STT |
Tên sản phẩm |
Đơn vị |
Công suất tối đa |
|
1 |
Dược phẩm các loại |
Tấn/năm |
445 |
|
Tổng |
Tấn/năm |
445 |
|
(Nguồn: Công ty Cổ phần Dược phẩm ..., 2024)
1.3.2.Công nghệ sản xuất của cơ sở
Hiện tại, Cơ sở đã ngưng sản xuất dòng sản phẩm viên nang mềm. Công nghệ sản xuất các dòng sản phẩm khác của Cơ sở không thay đổi Đề án bảo vệ môi trường chi tiết số 109/QĐ-BQL đã được Ban quản lý các Khu công nghiệp tỉnh Bình Dương phê duyệt ngày 25/04/2016.
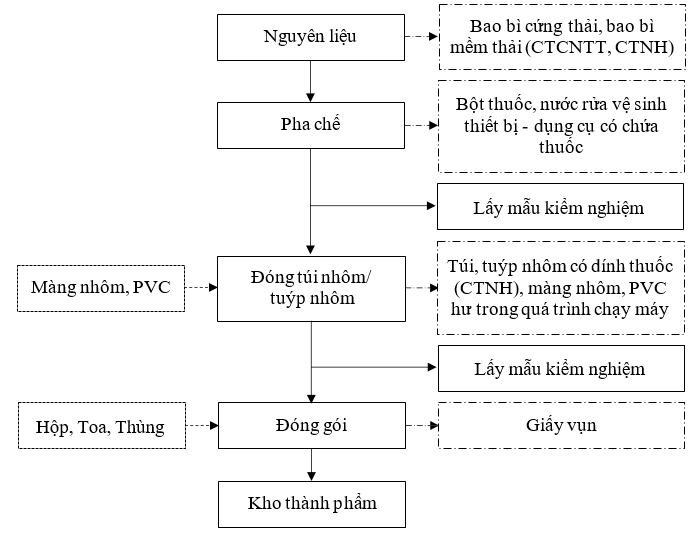
1.3.2.1.Sản xuất thuốc dạng gel và hỗn hợp dịch-kem
Hình 1. 2. Quy trình sản xuất thuốc dạng gel và hỗn hợp dịch-kem
Thuyết minh quy trình:
Bảng 1. 3. Thuyết mình quy trình sản xuất thuốc dạng gel và hỗn hợp dịch-kem
|
Công đoạn |
Thuyết minh quy trình |
Ô nhiễm phát sinh |
|
Bước 1: Chuẩn bị nguyên liệu |
Các nguyên liệu được chuyển vào phòng cân trước khi đưa vào sản xuất để cân cấp phát theo lệnh sản xuất. Tùy theo dạng hỗn dịch được yêu cầu sẽ tiến hành pha chế theo các kỹ thuật và phương pháp bào chế thích hợp. Nguyên liệu sau đó được chuyển tới khu vực pha chế. |
Bao bì cứng thải, bao bì mềm thải đựng nguyên liệu |
|
Bước 2: Pha chế |
Các nguyên liệu sau khi được cung cấp theo công thức của từng loại sẽ được khuấy đều cùng với nước (đã được định lượng sẵn) bằng máy tạo thành dạng |
Bột thuốc là nguyên liệu rơi vãi, nước rửa vệ sinh thiết bị - dụng cụ có chứa thuốc |
|
Công đoạn |
Thuyết minh quy trình |
Ô nhiễm phát sinh |
|
|
kem/gel. Bán thành phẩm sẽ được lấy mẫu kiểm nghiệm. |
|
|
Bước 3: Đóng túi nhôm, tuýp nhôm |
Bán thành phẩm sau khi phối trộn được đưa vào máy đóng gói dạng túi/tuýp để đóng vào bao bì túi, gói/tuýp nhôm. Sau khi đóng túi/tuýp hoàn tất, thành phẩm sẽ được lấy mẫu kiểm nghiệm. |
Túi, tuýp nhôm có dính thuốc (CTNH), màng nhôm, PVC hư trong quá trình chạy máy |
|
Bước 4: Đóng gói |
Các tuýp/túi thành phẩm sẽ được đóng gói vào hộp, toa, thùng và dán tem. |
Giấy vụn do thùng, hộp, toa hư hỏng |
|
Bước 5: Nhập kho |
Thành phẩm hoàn tất sẽ được nhập kho chờ xuất hàng. |
- |
(Nguồn: Công ty Cổ phần Dược phẩm ......)
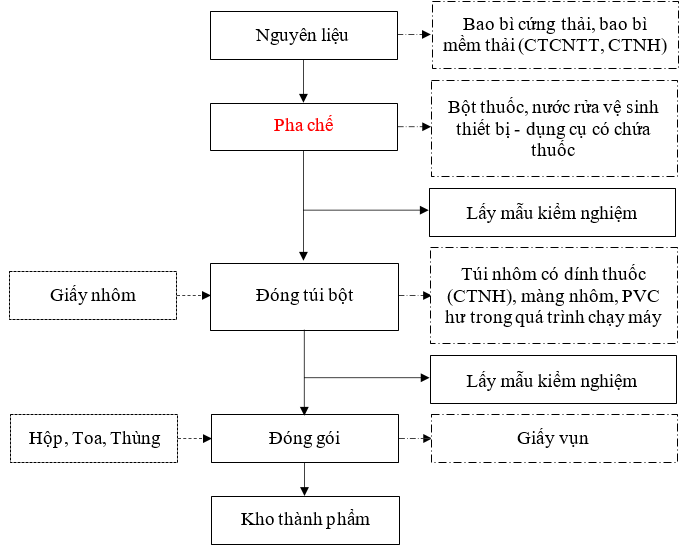
1.3.2.2.Sản xuất thuốc gói dạng bột
Hình 1. 3. Quy trình sản xuất thuốc gói dạng bột
Thuyết minh quy trình:
Bảng 1. 4. Thuyết mình quy trình sản xuất thuốc gói dạng bột
|
Công đoạn |
Thuyết minh quy trình |
Ô nhiễm phát sinh |
|
Bước 1: Chuẩn bị nguyên liệu |
Các nguyên liệu được chuyển vào phòng cân trước khi đưa vào sản xuất để cân cấp phát theo lệnh sản xuất. Tùy theo dạng thuốc được yêu cầu sẽ tiến hành pha chế theo các kỹ thuật và phương pháp bào chế thích hợp. Nguyên liệu sau đó được chuyển tới khu vực pha chế. |
Bao bì cứng thải, bao bì mềm thải đựng nguyên liệu |
|
Bước 2: Pha chế |
Các nguyên liệu sau khi được cung cấp theo công thức của từng loại sẽ được phối trộn cùng với nước, đánh tạo hạt và sấy khô bằng máy sấy gia nhiệt bằng điện. Bán thành phẩm sẽ được lấy mẫu kiểm nghiệm. |
Bột thuốc là nguyên liệu rơi vãi, nước rửa vệ sinh thiết bị - dụng cụ có chứa thuốc |
|
Bước 3: Đóng túi bột |
Bán thành phẩm sau khi phối trộn được đưa vào máy đóng gói túi bột bằng giấy để đóng vào bao bì túi. Thành phẩm sẽ được lấy mẫu kiểm nghiệm. Sau đó các túi được đóng thành các hộp, toa theo yêu cầu của từng dòng sản phẩm. |
Túi nhôm có dính thuốc (CTNH), màng nhôm, PVC hư trong quá trình chạy máy |
|
Bước 4: Đóng gói |
Các tuýp/túi thành phẩm sẽ được đóng gói vào hộp, toa, thùng và dán tem. |
Giấy vụn do thùng, hộp, toa hư hỏng |
|
Bước 5: Nhập kho |
Thành phẩm hoàn tất sẽ được nhập kho chờ xuất hàng. |
- |
(Nguồn: Công ty Cổ phần Dược phẩm ...)
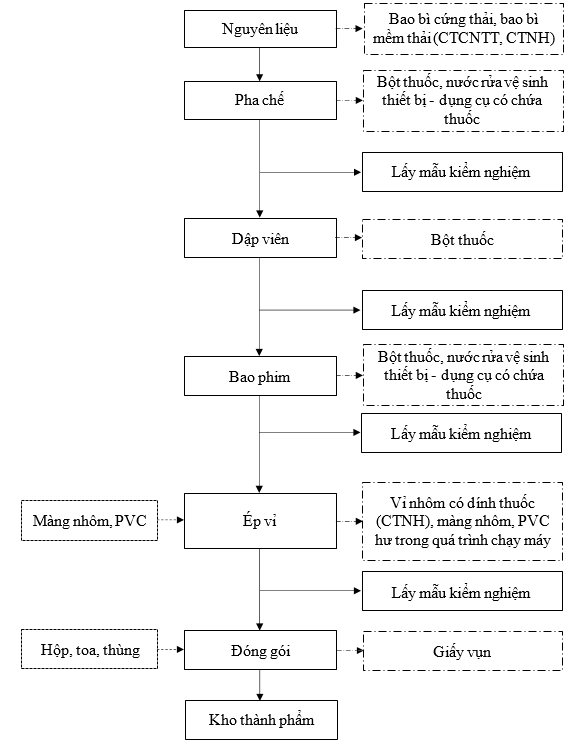
1.3.2.3.Sản xuất thuốc viên nén – viên nén bao phim
Hình 1. 4. Quy trình sản xuất thuốc viên nén – viên nén bao phim
Thuyết minh quy trình:
Bảng 1. 5. Thuyết mình quy trình sản xuất thuốc viên nén – viên ném bao phim
|
Công đoạn |
Thuyết minh quy trình |
Ô nhiễm phát sinh |
|
Bước 1: Chuẩn bị nguyên liệu |
Các nguyên liệu được chuyển vào phòng cân trước khi đưa vào sản xuất để cân cấp phát theo lệnh sản xuất. Tùy theo dạng viên được yêu cầu sẽ tiến hành pha chế theo các kỹ thuật và phương pháp bào chế thích hợp. Nguyên liệu sau đó được chuyển tới khu vực pha chế. |
Bao bì cứng thải, bao bì mềm thải đựng nguyên liệu |
|
Bước 2: Pha chế |
Các nguyên liệu sau khi được cung cấp theo công thức của từng loại sẽ được phối trộn cùng nhau. Nguyên liệu sau khi phối trộn được đưa vào máy sấy tầng sôi. Máy sây tầng sôi hoạt động theo nguyên tắc trao đổi nhiệt giữa không khí nóng và hạt sản phẩm. Một luồng không khí được làm nóng bằng cách gia nhiệt sẽ được thổi từ dưới lên xuyên qua các khe hở vào buồng sấy. Dòng nguyên liệu sẽ được phun trực tiếp từ trên xuống tiếp xúc trực tiếp với dòng khi nóng. Tại buồng làm việc khi nhiệt độ lên cao sẽ làm áp suất trong buồng cũng tăng theo quá trình bốc hơi nước của sản phẩm diễn ra. Khi nguyên liệu bốc hơi thì quá trình tạo hạt cũng hoàn thành. Bán thành phẩm sẽ được lấy mẫu kiểm nghiệm. |
Bột thuốc là nguyên liệu rơi vãi, Nước rửa vệ sinh thiết bị - dụng cụ có chứa thuốc |
|
Bước 3: Dập viên |
Bán thành phẩm sau khi pha chế được đưa qua máy dập viên tạo thành có viên thuốc nén. Sau đó tiếp tục lấy mẫu viên nén đi kiểm nghiệm. Thuốc dạng viên nén sẽ được đưa tới bước ép vỉ, thuốc dạng viên nén bao phim sẽ được đưa qua dây chuyền bao phim. |
Bột thuốc là nguyên liệu rơi vãi |
|
Bước 4: Bao phim |
Viên nén sau đó được phun một lớp màng mỏng polyme lên bề mặt viên để bảo vệ, kiểm soát giải phóng và được sấy khô. Bán thành phẩm sẽ được lấy mẫu kiểm nghiệm. |
Bột thuốc là nguyên liệu rơi vãi, Nước rửa vệ sinh thiết bị - dụng cụ có chứa thuốc |
|
Công đoạn |
Thuyết minh quy trình |
Ô nhiễm phát sinh |
|
Bước 5: Ép vỉ |
Viên nén đã được bao phim được đưa vào máy ép vỉ màng nhôm. Sau khi ép vỉ hoàn tất, thành phẩm sẽ được lấy mẫu kiểm nghiệm. |
Vỉ nhôm có dính thuốc (CTNH), màng nhôm, PVC hư trong quá trình chạy máy |
|
Bước 6: Đóng gói |
Các vỉ thuốc thành phẩm sẽ được đóng gói vào hộp, toa, thùng và dán tem. |
Giấy vụn |
|
Bước 7: Nhập kho |
Thành phẩm hoàn tất sẽ được nhập kho chờ xuất hàng. |
- |
(Nguồn: Công ty Cổ phần Dược phẩm ....)
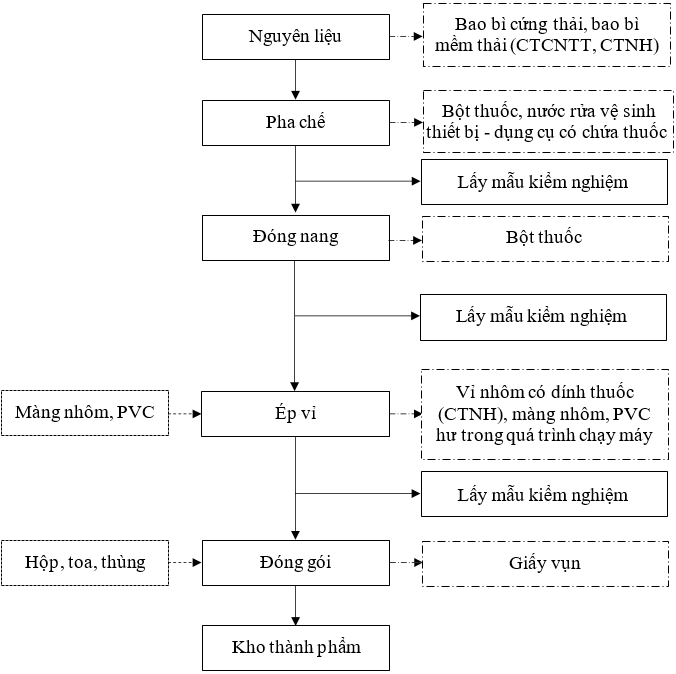
1.3.2.3.Sản xuất thuốc viên nang cứng
Hình 1. 5. Quy trình sản xuất thuốc viên nang cứng
Thuyết minh quy trình:
Bảng 1. 6. Thuyết mình quy trình sản xuất thuốc viên nang cứng
|
Công đoạn |
Thuyết minh quy trình |
Ô nhiễm phát sinh |
|
Bước 1: Chuẩn bị nguyên liệu |
Các nguyên liệu được chuyển vào phòng cân trước khi đưa vào sản xuất để cân cấp phát theo lệnh sản xuất. Nguyên liệu sau đó được chuyển tới khu vực pha chế. |
Bao bì cứng thải, bao bì mềm thải đựng nguyên liệu |
|
Bước 2: Pha chế |
Các nguyên liệu sau khi được cung cấp theo công thức của từng loại sẽ được phối trộn cùng với nước. Nguyên liệu sau khi phối trộn được đưa vào máy sấy tầng sôi. Máy sây tầng sôi hoạt động theo nguyên tắc trao đổi nhiệt giữa không khí nóng và hạt sản phẩm. Một luồng không khí được làm nóng bằng cách gia nhiệt sẽ được thổi từ dưới lên xuyên qua các khe hở vào buồng sấy. Dòng nguyên liệu sẽ được phun trực tiếp từ trên xuống tiếp xúc trực tiếp với dòng khi nóng. Tại buồng làm việc khi nhiệt độ lên cao sẽ làm áp suất trong buồng cũng tăng theo quá trình bốc hơi nước của sản phẩm diễn ra. Khi nguyên liệu bốc hơi thì quá trình tạo hạt cũng hoàn thành. Bán thành phẩm sẽ được lấy mẫu kiểm nghiệm. |
Bột thuốc là nguyên liệu rơi vãi Nước rửa vệ sinh thiết bị - dụng cụ có chứa thuốc |
|
Bước 3: Đóng nang |
Bán thành phẩm sau khi được tạo hạt sẽ được đóng vào vỏ nang rỗng và sấy. |
Bột thuốc, viên nang chứa thuốc |
|
Bước 4: Ép vỉ |
Viên nang tiếp tục được đưa vào máy ép vỉ màng nhôm. Sau khi ép vỉ hoàn tất, thành phẩm sẽ được lấy mẫu kiểm nghiệm. |
Vỉ nhôm có dính thuốc (CTNH), màng nhôm, PVC hư trong quá trình chạy máy |
|
Bước 5: Đóng gói |
Các vỉ thuốc thành phẩm sẽ được đóng gói vào hộp, toa, thùng và dán tem. |
Giấy vụn |
|
Bước 6: Nhập kho |
Thành phẩm hoàn tất sẽ được nhập kho chờ xuất hàng. |
- |
(Nguồn: Công ty Cổ phần Dược phẩm ...)
1.3.3.Sản phẩm của cơ sở
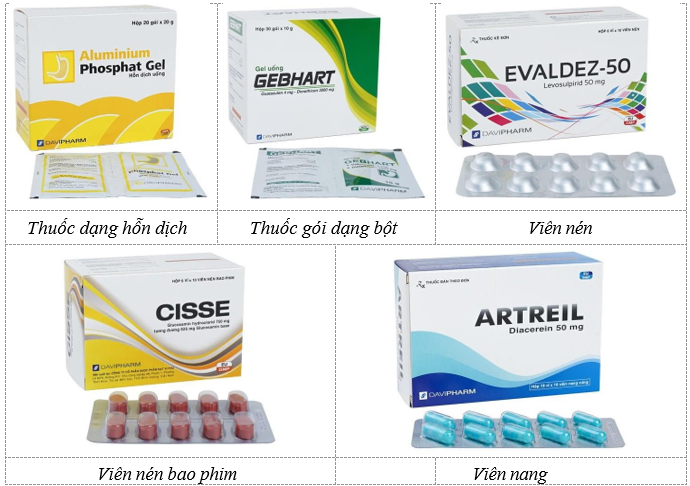
Sản phẩm của Cơ sở là dược phẩm các loại với hơn 300 đầu thuốc phân phối toàn quốc phục vụ cho các bệnh nhân tại Việt Nam.
Hình 1. 6. Hình ảnh một số sản phẩm của cơ sở
1.4.NGUYÊN LIỆU, NHIÊN LIỆU, VẬT LIỆU, ĐIỆN NĂNG, HÓA CHẤT SỬ DỤNG, NGUỒN CUNG CẤP ĐIỆN, NƯỚC CỦA CƠ SỞ
1.4.1.Nguyên, nhiên, vật liệu và hóa chất sử dụng tại cơ sở
Tùy thuộc vào nhu cầu của thị trường đối với từng loại thuốc, thành phần của mỗi loại thuốc khác nhau nên khối lượng của các nguyên liệu sản xuất có thể thay đổi nhưng tổng khối lượng sản xuất không quá 445 tấn/năm.
Nguyên liệu sử dụng cho việc sản xuất tại cơ sở năm 2023 được trình bày theo bảng 1.6.
Bảng 1. 7. Nhu cầu sử dụng nguyên liệu tại cơ sở năm 2023
|
STT |
TÊN NGUYÊN LIỆU |
ĐƠN VỊ |
SỐ LƯỢNG |
NGUỒN CUNG CẤP |
|
1. |
Sorbitol lỏng/ Neosorb 70/70 |
Kg/năm |
49.650 |
Trong nước |
|
2. |
Nhôm phosphat 20% |
Kg/năm |
41.950 |
Trong nước |
|
3. |
Cồn Tinh luyện 96º/Ethanol 96º |
Kg/năm |
39.575 |
Trong nước |
|
STT |
TÊN NGUYÊN LIỆU |
ĐƠN VỊ |
SỐ LƯỢNG |
NGUỒN CUNG CẤP |
|
4. |
Nước qua lọc RO |
Kg/năm |
31.200 |
Trong nước |
|
5. |
Propylen Glycol |
Kg/năm |
20.250 |
Trong nước |
|
6. |
Microcrystalline Cellulose M101/Acecel 101 |
Kg/năm |
18.800 |
Trong nước |
|
7. |
Microcrystalline Cellulose M112/ Hicel 112 |
Kg/năm |
17.980 |
Trong nước |
|
8. |
Magnesium Hydroxide |
Kg/năm |
15.850 |
Trong nước |
|
9. |
Dried Aluminium Hydroxide Gel USP |
Kg/năm |
14.580 |
Trong nước |
|
10. |
Cellactose 80 |
Kg/năm |
9.760 |
Trong nước |
|
11. |
Piracetam EP |
Kg/năm |
9.390 |
Trong nước |
|
12. |
Lactose Monohydrate/ Lactose HMS Impalpable Grade 200M |
Kg/năm |
8.020 |
Trong nước |
|
13. |
Prosolv SMCC90 / Silicified Microcrystalline Cellulose NF |
Kg/năm |
7.520 |
Trong nước |
|
14. |
Mannitol 60 (Pearlitol 160C) |
Kg/năm |
6.490 |
Trong nước |
|
15. |
Sucralfate USP Powder |
Kg/năm |
5.865 |
Trong nước |
|
16. |
Lactose Monohydrate/ Granulac 200 |
Kg/năm |
5.660 |
Trong nước |
|
17. |
Flowlac 100/ Supertab 11SD |
Kg/năm |
5.480 |
Trong nước |
|
18. |
Calcium Lactate Gluconate |
Kg/năm |
4.565 |
Trong nước |
|
19. |
Dimethicone BP-100cSt |
Kg/năm |
4.245 |
Trong nước |
|
20. |
Almagate BP |
Kg/năm |
3.890 |
Trong nước |
|
21. |
Dioctahedral Smectite |
Kg/năm |
3.600 |
Trong nước |
|
22. |
Primellose (Croscarmellose Sodium/ Solutab A) |
Kg/năm |
3.590 |
Trong nước |
|
23. |
Gelatin 200 Bloom/ (Vinh Wellness Gelatin ) |
Kg/năm |
3.445 |
Trong nước |
|
24. |
Candesartan Cilexetil |
Kg/năm |
3.440 |
Trong nước |
|
25. |
Maize starch powder/ Amidon de mais (Tinh bột ngô) |
Kg/năm |
3.290 |
Trong nước |
|
26. |
Crospovidon XL10 (Polyplasdone XL- 10) |
Kg/năm |
3.210 |
Trong nước |
|
27. |
Magnesium Stearate |
Kg/năm |
3.180 |
Trong nước |
>>> XEM THÊM: Lập báo cáo đánh giá tác động môi trường Bệnh viện chợ Rẫy 2 (ĐTM)
GỌI NGAY – 0903649782 - 028 35146426
Tin liên quan
- › Báo cáo đề xuất cấp giấy phép môi trường nhà máy chế tạo thiết bị cơ khí
- › Báo cáo đề xuất cấp GPMT dự án nhà máy sản xuất máy nén khí
- › Báo cáo đề xuất cấp giấy phép môi trường nhà xưởng nấu đúc, cán kéo nhôm
- › Báo cáo đề xuất cấp Giấy phép môi trường nhà máy sản xuất thực phẩm
- › Báo cáo đề xuất cấp giấy phép môi trường nhà máy sản xuất tấm Fiber Cement
- › Báo cáo đề xuất cấp GPMT dự án sản xuất vật liệu mới
- › Báo cáo đề xuất cấp giấy phép môi trường nhà máy sản xuất ba lô, túi xách
- › Báo cáo đề xuất cấp giấy phép môi trường nhà máy sản xuất bia
- › Báo cáo đề xuất cấp giấy phép môi trường nhà máy gạch
- › Báo cáo đề xuất Giấy phép môi trường cơ sở nhà máy chế biến bột cá












Gửi bình luận của bạn